Изотермическая ПЦР — обзор метода диагностики инфекций растений

Текст: Ю. Ф. Дрыгин, д-р хим. наук, доц., зав. лабораторией, НИИ физико-химической биологии им. А. Н. Белозерского Московского государственного университета имени М. В. Ломоносова; ФГУ «ФИЦ “Фундаментальные основы биотехнологии” РАН»
Технологии массовой диагностики инфекций высших организмов развиваются стремительно. Методики и оборудование, ранее доступные только специалистам в прогрессивных научных лабораториях, сегодня уже имеются в распоряжении сельхозпроизводителей, у которых появилась возможность проведения анализа на молекулярном уровне в полевых условиях.
Известно, что сельскохозяйственные культуры повсеместно заражаются микроорганизмами: вироидами, вирусами, бактериями и грибами. Поскольку заболевания растений на практике не лечатся, главными средствами борьбы с ними являются создание устойчивых к тем или иным инфекциям сортов, своевременная профилактика и точная диагностика с целью выбраковки больного материала, причем последняя считается наиболее экономически выгодной. Сегодня эффективной технологией установления наличия заболеваний считается метод полимеразной цепной реакции (ПЦР), из которого на основе сугубо лабораторных методов образовалась рутинная методика изотермической ПЦР.
НА МОЛЕКУЛЯРНОМ УРОВНЕ
Специфика диагностики инфекций широкого круга фитопатогенов, значительно различающихся по морфологии, структуре и физико-химическим свойствам, как в посадочном материале, так и непосредственно в поле определяет методы, которые применимы для массового анализа, то есть для десятков или сотен образцов одновременно. Данные способы должны сочетать в себе избирательность установления целевого патогена, чувствительность детекции, достаточную для его выявления в полевом материале, производительность, удовлетворяющую экономический аспект производства, скорость, необходимую в экстренных случаях при массовых инфекциях, а также ценовую и эксплуатационную доступность.
Как известно, даже самые простые патогены растений представляют собой молекулу рибонуклеиновой кислоты. Более сложные структуры, например вирусы и бактерии, обязательно содержат определенные мишени — специфические белок или нуклеиновую кислоту (НК). Молекулярная диагностика (МД) инфекций является частным случаем выявления целевых нуклеотидной последовательности и/или антигена патогенов. Она базируется на двух принципах молекулярного узнавания: нуклеиново-нуклеинового по правилам комплементарного спаривания гетероциклических оснований НК, а также белок-белкового — по формуле «белковый антиген — антитело» с использованием методов иммуноферментного анализа (ИФА) или иммунохроматографических тест-систем. Сегодня чувствительность такой диагностики достигла предела — в анализируемой пробе достоверно может быть обнаружена даже одна молекула НК патогена. Таким образом, исследование на молекулярном уровне ставит окончательный диагноз зараженности растений тем или иным микроорганизмом. При этом природа хозяина и патогена не имеет значения, поскольку методы детекции одинаковы — меняется только способ подготовки образца к изучению. Для проведения анализа нужны микроколичества материала — до нанограммов.
ВЫБОР МЕТОДА
Диагностический анализ на молекулярном уровне как НК, так и белкового антигена патогенов состоит из нескольких стадий. Первый этап подразумевает сбор материала и его хранение. Если не удается провести исследование свежесобранной пробы, то она замораживается и содержится при –20ºС или –70ºС, поскольку в зависимости от стадии роста и срока хранения при комнатной температуре в растениях накапливаются различные вещества, в частности продукты автолиза, полифенолы и другие, осложняющие проведение исследования. Вторая стадия предполагает выбор метода анализа. Диагностика значительно упрощается, если известна протяженная последовательность нуклеотидов НК патогена или его специфический антиген, а также доступны антитела к нему. В противном случае необходимо получение очищенных препаратов микроорганизма, выделение его НК и определение последовательности нуклеотидов протяженного участка или отбор и очистка специфического антигена.
Следует отметить, что наибольший вред злаковым зерновым культурам приносят инфекции, вызванные грибами, причем они представляют угрозу как для живого растения, так и для находящегося на хранении сырья. Некоторые из этих микроорганизмов выделяют токсины, опасные для здоровья млекопитающих. В данном случае метод обнаружения грибной инфекции упрощается: определение ядовитого вещества иммунометодами значительно легче, чем выявление самого патогена.
ПОЛУЧИТЬ РЕЗУЛЬТАТ
Следующая стадия представляет собой подготовку образца к анализу. Клеточные экстракты содержат множество веществ, которые мешают постановке диагноза, поэтому необходим препарат предварительно очищенного патогена. Для этого требуются лабораторное оборудование и квалифицированный персонал, причем получение целевого материала занимает часы и иногда дни. Множество компаний предлагает свои наборы для подготовки проб с целью проведения анализа, однако разнообразие объектов исследования так велико, что универсального способа до сих пор не существует. Для диагностики инфекций растений удобным материалом является свежая листовая ткань, так как получение препарата из коры, семян или полежавших клубней значительно сложнее. Явная инфекция в подготовленном образце может быть идентифицирована в течение 15–30 минут. При начальной стадии заражения, когда требуется определить малое число молекул патогенного организма, время анализа может составлять несколько часов. В сложных случаях требуется некоторое количество положительных и отрицательных контролей и дополнительное подтверждение достоверности диагностики независимым способом.
Заключительная стадия — обработка результатов. Поскольку МД претендует на постановку окончательного диагноза, важно проведение повторного исследования с последующей обработкой полученных сведений с помощью математической статистики или подтверждение итогов первого анализа независимым методом.
ВЫСОКАЯ ЧУВСТВИТЕЛЬНОСТЬ
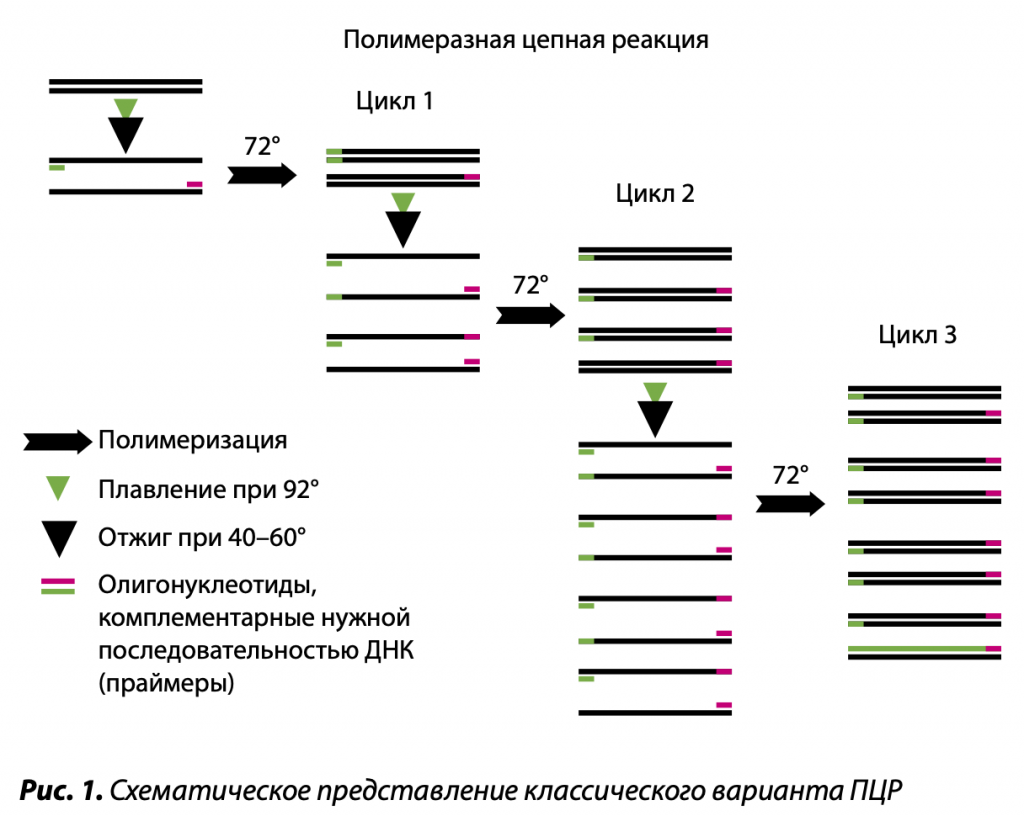
Наиболее быстро адаптируемой к сельскохозяйственной практической диагностике технологией определения НК патогенов является полимеразная цепная реакция. Она содержит более десяти методов амплификации, то есть размножения, в десятки и сотни миллионов раз фрагмента нуклеиновой кислоты микроорганизма. Как известно, ДНК представляет собой спираль, состоящую из двух нитей полинуклеотидов. Они являются полярными, и у них различаются 5’- и 3’-концы, при этом синтез идет в направлении 5’g3’ навстречу друг другу. В классической ПЦР размножается фрагмент ДНК патогена длиной от ста до нескольких сот нуклеотидов, последовательность которых известна. В анализе к образцу, содержащему целевую ДНК, добавляются в молярном избытке по отношению к этой макромолекуле специфические праймеры — олигонуклеотиды, затравки синтеза, каждый из которых комплементарен определенным участкам одной из нитей ДНК патогена. Поскольку данные нити являются полярными и разнонаправленными, а копирование их происходит в противоположном направлении, выбранные праймеры определяют размер размножаемого между ними фрагмента ДНК. Комплементарное их спаривание с матричной ДНК определяет специфичность продукта ПЦР. Синтез дочерних макромолекул из 5’-дезоксинуклеозидтрифосфатов катализируется термоустойчивым ферментом — ДНК-полимеразой. Один цикл размножения состоит из нескольких стадий. Прежде всего, осуществляется плавление ДНК микроорганизма, а затем и дочерних ДНК, при температуре 90–95ºС, причем в этом случае комплементарные нити расходятся. После этого происходит отжиг при температуре, оптимальной для связывания праймеров, — 40–70ºС, а также синтез дочерней ДНК при 70ºС. В результате каждого цикла образуется копия фрагмента ДНК патогена, фланкированная праймерами.
ВАЖНЫЕ АСПЕКТЫ
В приборе для ПЦР циклы размножения повторяются 20–30 раз, в результате чего получается почти 220–230 образцов фрагмента макромолекулы в количествах, позволяющих использовать полную копию во многих приложениях лабораторной и практической диагностики. Данный продукт в варианте классической полимеразной цепной реакции определяется с помощью электрофореза в агарозном геле в присутствии флуоресцирующего красителя ДНК — бромистого этидия. В технологии ПЦР существует два аспекта, которые требуют особого внимания. Прежде всего, для проведения реакции необходимо предварительное получение препарата целевой нуклеиновой кислоты, очищенного от примесей, ингибирующих ДНК-полимеразы и обратные транскриптазы. Кроме того, классическая методика часто дает ложноположительные сигналы незараженного образца, поэтому для достоверности анализа необходима идентификация продукта ПЦР. Чаще ее проводят путем специфического комплементарного связывания материала с ДНК-зондом, меченным хромогенной или флуоресцентной меткой. Наиболее надежное доказательство так называемого родства продукта ПЦР с ДНК патогена дает метод определения последовательности нуклеотидов в целевой размноженной ДНК.
Известно, что большая часть вирусов высших организмов содержит РНК. В этом случае можно использовать технологию ОТ-ПЦР (RT-PCR) — полимеразную цепную реакцию, которой предшествует обратная транскрипция РНК патогена в комплементарную ДНК (кДНК). Данный процесс катализирует фермент под названием обратная транскриптаза. Сейчас реакции ОТ и ПЦР совмещают в одной пробирке. Продукты анализа определяются электрофорезом в геле агарозы или полиакриламида в присутствии флуоресцирующего красителя.
В РЕАЛЬНОМ ВРЕМЕНИ
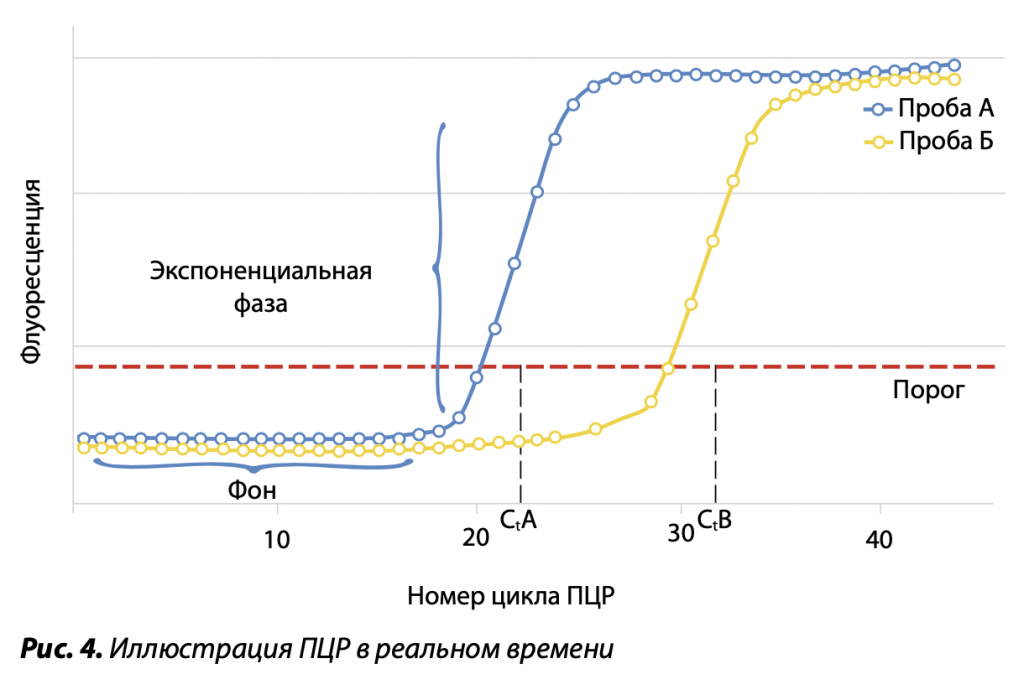
Широкое распространение получил метод ПЦР, в котором можно следить за динамикой накопления целевой кДНК в растворе в реальном времени. В продукты реакции включаются праймеры, которые помечены флуоресцентной меткой, либо ДНК-препараты окрашиваются красителем SYBR Green. Более высокая точность этого анализа в сравнении с классической ПЦР получается за счет использования флуоресцентных красителей с высоким квантовым выходом и чувствительного детектора флуоресценции в растворе. В рамках данного метода исследование продуктов синтеза электрофорезом в геле не требуется. Специфичность продуктов реакции определяется сравнением динамик трех результатов размножения: целевой ДНК и продукта кПЦР с праймером, гибридизующимся с внутренней частью фрагмента ДНК, с заданным количеством ДНК контрольного образца с его специфической парой праймеров. Сравнение кинетики реакции проводится в так называемой пороговой точке экспоненциального синтеза препаратов кПЦР, выбираемой в каждом анализе. Степень накопления продуктов амплификации связана с исходным количеством исследуемой ДНК, что дает возможность точно оценить ее количество. По этой причине данный метод называют количественной ПЦР (кПЦР, qPCR). Последующее изучение кривых плавлений продукта кПЦР позволяет оценить его гомогенность. Если он не оказывается таковым, необходимо оптимизировать условия ПЦР.
ОСОБЕННОСТИ РЕАКЦИЙ
Одновременная ПЦР множества образцов (PCR arrays) — вариант анализа в реальном времени, который проводится в 96, а иногда вплоть до 1536 луночных планшетах. Для количественного определения в положительный контроль добавляется известное количество ДНК и специфичные праймеры. Одновременно можно анализировать как множество образцов с одним фрагментом целевой ДНК, так и ряд частей разных макромолекул или генов, причем в последнем случае важен подбор оптимальных пар праймеров и условий проведения исследования. Продукты реакции определяются количественно по флуоресценции их с красителем SYBR green.
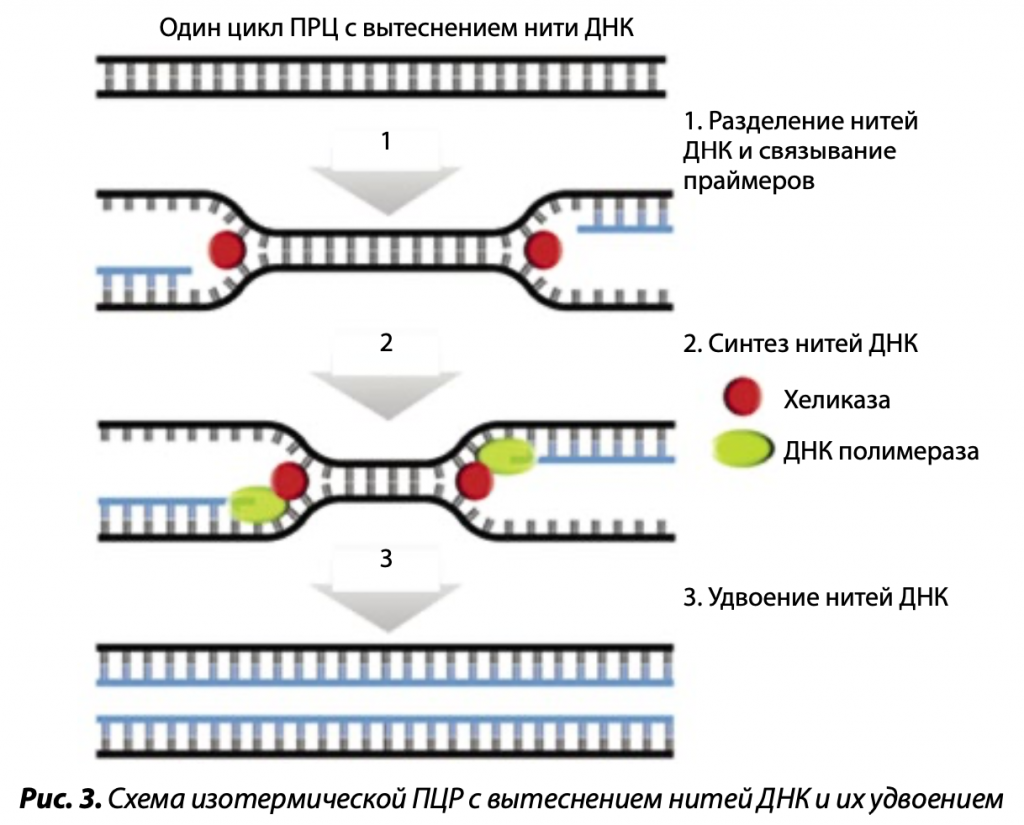
Изотермические ПЦР не требуют повторяющихся температурных циклов «плавление — отжиг — синтез цепи» и проходят при постоянной температуре, равной 37ºС или 60ºС. В этой реакции используются ДНК-полимеразы с высокой вытесняющей активностью, или дополнительно к ним добавляется фермент — ДНК-хеликаза, расплетающая двойную спираль макромолекулы. В связи с этим в изотермических ПЦР отпадает необходимость стадии термической денатурации ДНК. Такие ДНК-полимеразы, стартуя с праймера, связавшегося с матричной нитью, ведут синтез новой комплементарной нити, вытесняя старую. Различают несколько методов изотермической ПЦР: способ, в рамках которого подобранные праймеры образуют шпильки или петли, и технологию с вытеснением нити ДНК.
СОЗДАНИЕ ПЕТЕЛЬ
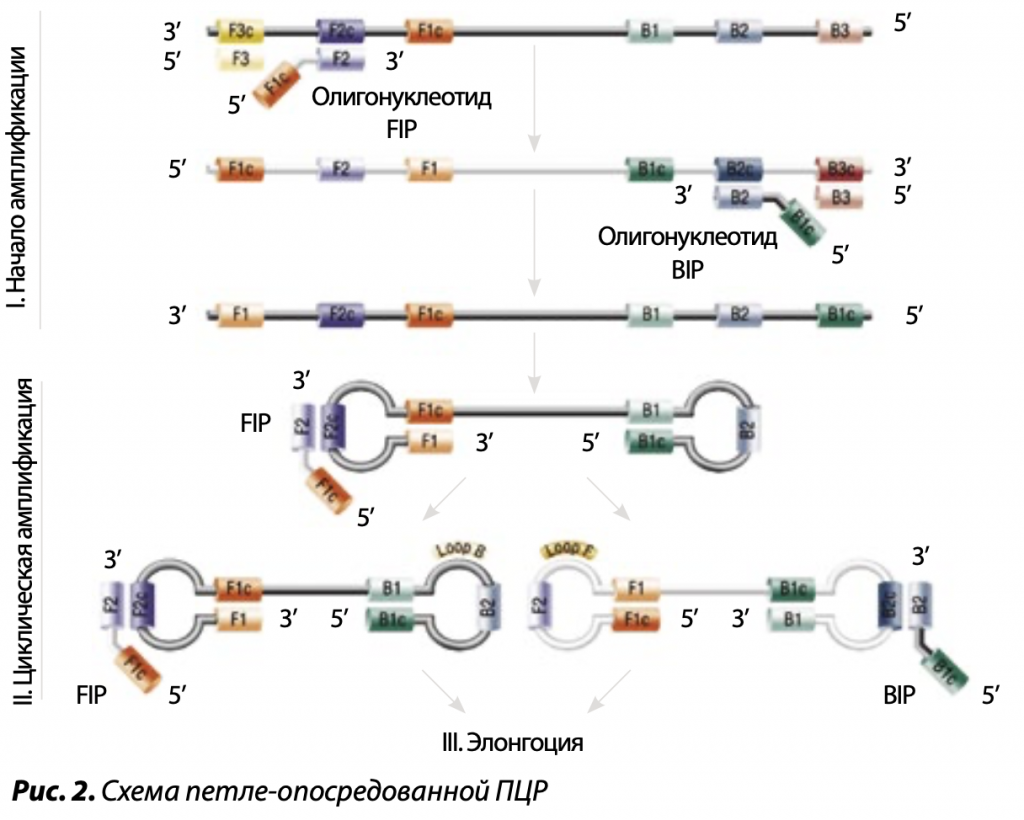
Ключевым ферментом петле-опосредованной изотермической ПЦР является термостабильная ДНК-полимераза Bst бациллы Bacillus stearothermophilus. Ее производное Bst 3.0, то есть улучшенный генетической инженерией вариант, обладает не только высокой эффективностью синтеза ДНК при 60ºС, но и хеликазной активностью, расплетающей двойные цепи ДНК — РНК и ДНК — ДНК и вытесняющей родительскую цепь дочерней. Более того, полимераза Bst 3.0 отличается действенностью обратной транскриптазы, что позволяет проводить две реакции ОТ и ПРР в одной пробирке. Этот фермент мало чувствителен к примесям, ингибирующим ДНК-полимеразы, и работает эффективно с грубо очищенными препаратами НК.
В петле-опосредованной ПЦР для образования петель на однонитевой ДНК используются две и более пар прямых и обратных праймеров, причем каждая из них специфически спаривается с несколькими комплементарными участками одной нити ДНК. В результате репликации продукт каждого цикла будет содержать петлю за счет внутримолекулярного взаимодействия в нити ДНК. Внутренние праймеры используются для изотермической ПЦР, а внешние подбираются таким образом, чтобы, спарившись с соседними участками с обоих концов этой же цепи макромолекулы, образовать петли. В этом случае их 3’-концы становятся затравками для комплементарной полимеризации навстречу друг другу дочерних ДНК. Полимераза эффективно вытесняет родительскую цепь, заменяя ее побочным фрагментом, при этом у дочерних цепочек также будут аналогичные петли.
ЭКОНОМИЯ И ДОСТОВЕРНОСТЬ
Изотермическая ПЦР обладает несколькими преимуществами в сравнении с классической полимерно-цепной реакцией. Прежде всего, отсутствует необходимость в амплификаторе, поскольку петле-опосредованная реакция проводится при постоянной температуре. Кроме того, при таком исследовании более высокую специфичность продукта реакции определяют несколько пар праймеров, при этом за счет внутримолекулярного праймирования возрастает специфичность и скорость синтеза дочерних ДНК на порядок. За 15–30 минут вырабатывается такое количество продукта, что за его образованием можно следить визуально как с помощью специального красителя, так и по появлению осадка пирофосфата магния — побочного явления полимеризации дезоксинуклеозидтрифосфатов. Для изотермических ПЦР доступны ДНК-полимеразы, более устойчивые к клеточным загрязнениям в препаратах макромолекулы.
Наиболее эффективным вариантом изотермической ПЦР при 37ºС, в котором используется ДНК-полимераза с высокой хеликазной активностью или хеликаза добавляется дополнительно, является тот, в котором реакции вытеснения родительской и синтезированных цепей ДНК совмещены с реакцией эндонуклеазы, вносящей одноцепочечные разрывы в ДНК с образованием 3’-концов – затравок для синтеза ДНК. Множество точек праймирования этого процесса приводит к быстрому экспоненциальному образованию фрагментов дочерних ДНК различной длины, комплементарных родительской цепочке. В результате время, необходимое для постановки диагноза о наличии инфекции этим вариантом ПЦР, может составлять 5–10 мин. Сегодня данное исследование как наиболее простой метод используется в практической молекулярной диагностике и может эффективно применяться в сельском хозяйстве.
Необходимость массового внедрения и использования доступных систем диагностики инфекций растений на молекулярном уровне в нашей стране сегодня вполне очевидна. Подобные технологии помогут не только повысить урожайность культур, возделываемых сельхозпроизводителями, но и сформировать отечественный рынок качественного и безвирусного семенного материала.
